|
||||
|
ИНФАРКТ МИОКАРДА Инфаркт миокарда – это острый некроз участка сердечной мышцы, возникающий вследствие абсолютной или относительной недостаточности его кровоснабжения. В подавляющем большинстве случаев (97 %) непосредственной причиной инфаркта миокарда является тромботическая окклюзия коронарных артерий. Исключение составляет инфаркт миокарда, вызванный длительным спазмом коронарных артерий, резким и продолжительным повышение потребности миокарда в кислороде. Известны случаи развития инфаркта миокарда при травме, артериите, аномалии, расслоении, эмболии коронарных артерий, заболеваниях крови, пороках сердца, особенно аортальных, расслаивающей аневризме аорты, тиреотоксикозе, тяжелой гипоксии, анемии и других заболеваниях и состояниях. Подавляющее большинство летальных исходов при инфаркте миокарда развиваются в первые часы заболевания на догоспитальном этапе. Из общего числа заболевших каждый четвертый погибает в течение первых шести часов от начала сердечного приступа. ДиагностикаОсновой диагностики инфаркта миокарда, особенно в первые часы заболевания, являются тщательный анализ болевого синдрома с учетом анамнеза, указывающего на наличие ИБС или соответствующих факторов риска, а в дальнейшем – появление изменений ЭКГ и повышение активности кардиоспецифических ферментов или содержания миокардиальных белков в крови. Выделяют несколько вариантов начала инфаркта миокарда: ангинозный, аритмический, цереброваскулярный, астматический, абдоминальный, малосимптомный (безболевой). Ангинозный – самый частый вариант дебюта инфаркта миокарда. Характер ангинозной боли при инфаркте миокарда аналогичен таковому при стенокардии. Больные описывают возникающие ощущения как сильное сжатие, сдавление, тяжесть («стянуло обручем, сжало тисками»). При большой интенсивности боль воспринимается как «кинжальная», раздирающая, разрывающая, жгучая, палящая, как «кол в грудной клетке». Болевые ощущения протекают волнообразно, периодически уменьшаясь, но не прекращаясь полностью. С каждой новой волной приступы усиливаются, быстро достигают максимума, а затем ослабевают, и промежутки между ними удлиняются. Локализация ангинозной боли – обычно за грудиной в глубине грудной клетки, реже – в левой половине грудной клетки или в надчревной области. Иногда эпицентр боли смещается в правую половину грудной клетки, шею, нижнюю челюсть. Иррадиирует ангинозная боль, как правило, в левую лопатку, плечо, предплечье, кисть. Чаще, чем при стенокардии, боль широко отражается в обе лопатки, оба плеча и предплечья, надчревную область, шею, нижнюю челюсть, причем иррадиацию в шею и обе лопатки считают более специфичной. Начало ангинозной боли при инфаркте миокарда – внезапное, часто в утренние часы, длительность – несколько часов. Окончание боли. Повторный сублингвальный прием нитроглицерина не устраняет боль полностью, но может ее несколько ослабить. Особенности ангинозного болевого синдрома при инфаркте миокарда зависят от локализации и течения заболевания, фона, на котором оно развивается, и возраста больного. У 90 % молодых больных ангинозный статус проявляется ярко. Боли часто носят сжимающий, сверлящий, режущий, жгучий характер, трудно поддаются терапии, рецидивируют. Напротив, у 30 % больных пожилого и старческого возраста типичная загрудинная боль вообще не наблюдается. К аритмическому варианту заболевания относят случаи, когда инфаркт миокарда начинается с острых нарушений ритма или проводимости сердца при отсутствии боли. Чаще аритмический вариант проявляется фибрилляцией желудочков, реже – аритмическим шоком, обусловленным пароксизмом тахикардии (тахиаритмии) или острой брадикардией. Нередко аритмический вариант клинически дает знать о себе обмороком. Цереброваскулярный вариант наблюдается у больных с отягощенным неврологическим анамнезом и развивается на фоне значительного снижения или повышения артериального давления. Неврологическая симптоматика зависит от тяжести нарушений системного и регионарного (мозгового) кровообращения и может быть представлена головной болью, головокружением, тошнотой, рвотой, расстройством зрения, помрачением сознания (от легкой заторможенности до комы) и очаговыми неврологическими симптомами. У больных старческого возраста нарушение мозгового кровотока вследствие ухудшения кровообращения и снижения артериального давления может проявляться психозом. К цереброваскулярному варианту иногда относят синкопальные состояния в дебюте заболевания, однако они чаще обусловлены кратковременными эпизодами аритмий или развиваются на высоте боли. Астматический вариант инфаркта миокарда обычно встречается при повторном инфаркте миокарда или у больных с исходной недостаточностью кровообращения. Сердечная астма или отек легких в дебюте инфаркта миокарда могут быть обусловлены вовлечением в патологический процесс сосочковых мышц, а внезапная одышка без выраженного застоя в легких – поражением правого желудочка. Об астматическом варианте инфаркта миокарда следует думать тогда, когда ведущим симптомом заболевания является внезапный, часто немотивированный приступ удушья или отек легких. Абдоминальный вариант обычно наблюдается при локализации некроза на нижней стенке левого желудочка. Кроме смещения эпицентра болевых ощущений в надчревную область, реже – в область правого подреберья, при нем могут наблюдаться тошнота, рвота, метеоризм, расстройство стула, явления пареза кишечника, повышение температуры тела. Нередко отмечаются цианоз, одышка, аритмии, в то время как живот остается мягким, а симптомы раздражения брюшины отсутствуют. Малосимптомная (безболевая) форма инфаркта миокарда проявляется неспецифической симптоматикой (слабость, ухудшение сна или настроения, ощущение дискомфорта в грудной клетке). Малосимптомная форма инфаркта миокарда чаще встречается у больных пожилого возраста, особенно страдающих сахарным диабетом, и вовсе не является свидетельством благоприятного течения заболевания. ЭКГ при инфаркте миокарда относительно специфична, но отличается низкой чувствительностью. Признаки острого нарушения коронарного кровообращения часто искажаются другими патологическими изменениями ЭКГ и всегда запаздывают по отношению к началу ангинозного приступа. Эти обстоятельства снижают ценность однократно снятой ЭКГ, позволяющей, по данным различных авторов, диагностировать инфаркт миокарда лишь в 48–51 % случаев. В то же время неотложное электрокардиографическое исследование может иметь решающее значение для постановки правильного диагноза. Ценность этого метода диагностики проявляется не только при особо тяжелых или трудно дифференцируемых состояниях. Изменения ЭКГ могут оказаться единственным убедительным симптомом инфаркта миокарда при относительно кратковременной и легко устраненной ангинозной боли или при других нетипичных клинических проявлениях заболевания. Напротив, отсутствие электрокардиографических признаков нарушения коронарного кровообращения на фоне тяжелого многочасового болевого приступа может свидетельствовать о наличии другого заболевания (например, расслаивающей аневризмы аорты). Бесспорно, что диагностировать инфаркт миокарда нужно в первую очередь по клиническим признакам, но во всех случаях, когда он может быть заподозрен, необходима экстренная оценка ЭКГ. Подтверждение диагноза и определение ЭКГ-разновидности инфаркта миокарда имеет определяющее значение для выбора лечения, в первую очередь – содержания и объема неотложной антитромботической терапии. По электрокардиографическим признакам важно различать трансмуральный и субэндокардиальный инфаркт миокарда. При трансмуральном (крупноочаговом) некрозе поражается более 50–70 % толщи стенки левого желудочка. Так как большая часть миокарда под электродом теряет способность к возбуждению, то форму ЭКГ в прямых отведениях определяет вектор деполяризации противоположной стенки, формируя комплекс QRS или патологический зубец Q. Зубец Q считают патологическим при продолжительности 0,04 с или больше, при амплитуде больше 1/4 зубца R, а также если он появляется в грудных отведениях правее переходной зоны. Вектор сохранившейся части миокарда приводит к образованию зубца r с меньшей, чем исходная, амплитудой. При субэндокардиальном инфаркте миокарда патологический зубец Q не образуется, хотя может отмечаться зазубренность начальной части комплекса QRS. На ЭКГ проявляются признаки субэндокардиального повреждения, т. е. депрессия сегмента ST (максимально выраженная в отведениях V3—V5, реже – в отведениях III и aVP). Эти признаки свидетельствуют об инфаркте миокарда, если сохраняются не менее 48 ч, в дальнейшем закономерно изменяются и сопровождаются усилением активности кардиоспецифичных ферментов или повышением содержания миокардиальных белков в крови. Субэндокардиальные инфаркты всегда обширные, и хотя изменения реполяризации неточно очерчивают зону поражения, их нельзя относить к мелкоочаговым. 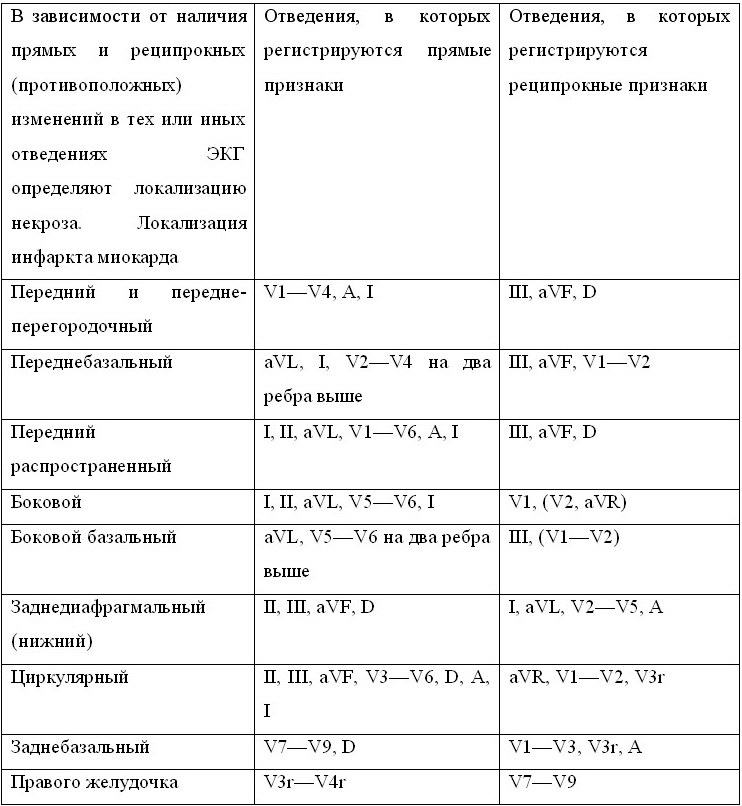 С течением времени ЭКГ при инфаркте миокарда претерпевает ряд динамических изменений. Выделяют три электрокардиографических стадии трансмурального инфаркта миокарда: острую, подострую, рубцовую. Острая стадия трансмурального инфаркта проявляется признаками некроза (появлением комплексов QS или патологических зубцов Q) и повреждения (подъемом сегмента ST выше изоэлектрической линии) миокарда. В самом начале острая стадия (иногда этот период называют острейшей стадией) проявляется признаками трансмурального повреждения миокарда (быстро нарастающими изменениями реполяризации: подъемом сегмента ST в виде монофазной кривой, преходящими нарушениями ритма и проводимости, снижением амплитуды зубца R, началом формирования патологического зубца Q). Выделение этого начального периода острой стадии имеет важное значение, так как позволяет определить содержание экстренной помощи (тромболитическая терапия или антикоагулянты), не дожидаясь появления прямых признаков некроза (комплексов QRS или патологических зубцов Q). Если при наличии клинических данных признаки повреждения миокарда (смещения сегмента ST) отсутствуют, то ЭКГ необходимо регистрировать повторно каждые 20–30 мин, чтобы не упустить время для начала тромболитической терапии. На протяжении острой стадии окончательно формируется зона некроза (формируются комплексы QS или патологические зубцы Q), за счет уменьшения возбуждающейся части миокарда снижается амплитуда зубца R. По мере уменьшения степени повреждения миокарда, окружающего некротический участок, сегмент ST приближается к изоэлектрической линии. Трансформация повреждения в ишемию приводит к появлению и нарастанию инверсии зубца Т. В конце острой стадии вся зона повреждения трансформируется в ишемическую, поэтому сегмент ST находится на изоэлектрической линии, а зубец Т – глубокий, отрицательный. Подострая стадия представлена зоной некроза (комплексы QS или патологические зубцы Q) и зоной ишемии (отрицательные зубцы Т). Динамика ЭКГ в этом периоде заболевания сводится к постепенному уменьшению ишемии (степени инверсии зубца Т). Рубцовая стадия. Для рубцовой стадии трансмурального инфаркта миокарда характерны наличие патологического зубца Q, сниженная амплитуда зубца R, расположение сегмента ST на изоэлектрической линии, стабильная форма зубца Т. Признаки рубцовых изменений на ЭКГ могут сохраняться пожизненно, но могут со временем исчезать. Распознавание инфаркта миокарда по ЭКГ может быть затруднено. К наиболее значимым факторам, затрудняющим диагностику, относятся: 1) отсутствие типичных изменений ЭКГ в начале инфаркта миокарда; 2) поздняя регистрация ЭКГ; 3) инфаркт миокарда без патологического зубца Q или с нечеткими изменениями зубца Q; 4) локализация некроза, при которой нет прямых изменений в обычных отведениях ЭКГ; 5) повторный инфаркт миокарда; 6) переднезадний инфаркт миокарда; 7) блокада ножек пучка Гиса и их разветвлений; 8) инфарктоподобные изменения ЭКГ при других заболеваниях и состояниях (ТЭЛА, синдром WPW и др.). Особенно актуальна проблема, связанная с запаздыванием появления изменений на ЭКГ относительно начала болевого синдрома. Отсутствие типичных изменений ЭКГ в начале инфаркта миокарда может наблюдаться в течение минут, а иногда и часов. Н. А. Мазур (1985) выделяет 5 вариантов изменений ЭКГ в течение первого часа развития инфаркта миокарда: 1) подъем сегмента SТ с патологическим зубцом Q или без него; 2) депрессия сегмента ST; 3) появление реципрокных изменений ЭКГ раньше, чем прямых; 4) образование патологического зубца Q раньше типичных изменений реполяризации (псевдорубцовая стадия); 5) отсутствие изменений ЭКГ. В случаях, когда в начале клинических проявлений инфаркта миокарда отсутствуют его электрокардиографические признаки, регистрацию ЭКГ следует повторять с интервалом 20–30 мин. На ранних стадиях заболевания заподозрить инфаркт миокарда по ЭКГ помогают: 1) появление отрицательной и, не в меньшей степени, положительной (псевдонормализация) динамики по сравнению с предыдущими ЭКГ; 2) появление высоких заостренных зубцов Т; 3) появление реципрокных изменений; 4) нарушения внутрижелудочковой проводимости (обычно при передне-перегородочных инфарктах); 5) нарушения АВ-проводимости (при заднедиафрагмальных инфарктах); 6) желудочковые экстрасистолы типа (QS, qR или QRS (но не QS) в прекардиальных отведениях; 7) регистрация дополнительных (V7—8, высоких и правых прекардиальных) отведений ЭКГ; 8) особая настороженность при анализе изменений в отведениях aVL, V5—6, III; 9) при низкоамплитудных зубцах регистрация ЭКГ с усилением 2:1. Изменения ЭКГ в первые часы инфаркта миокарда имеют определенное прогностическое значение. Прогностически неблагоприятными являются следующие электрокардиографические признаки: 1) высокая ЧСС; 2) значительный суммарный подъем сегмента ST; 3) выраженная депрессия сегмента ST в реципрокных отведениях; 4) увеличение продолжительности комплекса QRS до 0,11 с и более; 5) наличие признаков ранее перенесенного инфаркта миокарда (комплексов QS или патологических зубцов Q в удаленных от зоны острого инфаркта миокарда отведениях). Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ. Резорбционно-некротический синдром выявляется по результатам общеклинического и биохимического исследований крови: 1) лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; 2) увеличение СОЭ с 3—5-го дня; 3) повышение в крови активности ферментов – креатинфосфокиназы (КФК) и ее МВ-фракции (с первых часов, сохраняющееся 2–3 дня), аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой с конца первых суток, нормализующееся к 3—5-му дню), ЛДГ-лактатдегидрогеназы (общей) и ее первого и второго изоферментов, которое может держаться 10–14 дней. В настоящее время при острой коронарной патологии наряду с прочно вошедшими в клиническую практику лабораторными методами, такими как исследование уровня КФК, ЛДГ-1, КФК – МВ, широко используют новые маркеры – тропонин Т, тропонин И и миоглобин. Для экстренной диагностики инфаркта миокарда наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина-Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8—10 ч, второй начинается через трое суток. Нормализация концентрации тропонина-Т в крови происходит через 10–14 суток. Чувствительность теста через 3 ч – примерно 60 %, через 10 ч приближается к 100 %, специфичность – почти 100 %. С помощью этого метода удается диагностировать не только крупно-, но и мелкоочаговые повреждения миокарда, что имеет принципиальное значение у больных с нестабильной стенокардией. Для проведения анализа на тест-полоску наносят 150 мкл крови. Результат считывают через 20 мин. При инфаркте миокарда концентрация тропонина-Т превышает 0,2 нг/мл и на полоске появляются две линии. При наличии одной (контрольной) линии тест считают отрицательным (в ранние сроки для исключения инфаркта миокарда тест рекомендуют повторить через несколько часов). Отсутствие контрольной линии свидетельствует о том, что провести тест не удалось. Таким образом, метод прост и доступен, отличается высокой чувствительностью и специфичностью, позволяет диагностировать инфаркт миокарда как в ранние, так и в поздние сроки заболевания (в промежутке от 3 ч до 10 суток). Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц – тропонин Т (ТнТ), тропонин Ц (ТнЦ) и тропонин И (ТнИ). В начале 90-х годов были разработаны иммунологические методы, позволяющие с помощью моноклональных антител различать тропонины Т и И кардиомиоцитов и других поперечнополосатых мышечных волокон. Считается, что ТнИ и ТнТ являются наиболее чувствительными и специфичными маркерами некроза сердечной мышцы. Их уровень повышается в крови уже через 2–3 ч после инфаркта миокарда, увеличивается в 300–400 раз по сравнению с нормой и сохраняется повышенным в течение 10–14 дней. В последнее время появились данные о том, что уровень ТнТ может повышаться при ХПН и некоторых других патологических состояниях, в связи с чем большее предпочтение отдается ТнИ. Миоглобин – хромопротеид, сходный по строению с гемоглобином, – пигментный белок мышечной ткани, обеспечивающий депонирование в ней кислорода, что особенно важно для сердечной мышцы. У здоровых людей уровень миоглобина в крови, определяемый радиоиммунным методом, не превышает 80 мкг/л, а с мочой за сутки выделяется 0,4–4 мкг. При травмировании и ишемии мышц миоглобин, обладая малой молекулярной массой, быстро выделяется в кровь, а затем поступает в мочу. При ИМ содержание миоглобина в крови у большинства больных превышает 200 мкг/л через 4 ч после ангинозного приступа, а через 6 ч его уровень повышается у 100 % больных с впервые возникшим ИМ. Определение гипермиоглобинемии – наиболее достоверный тест для исключения острого ИМ в ранние экспресс-методы лабораторной диагностики инфаркта миокарда. Дифференциальная диагностикаНаиболее часто приходится дифференцировать инфаркт миокарда от затянувшегося приступа стенокардии, ТЭЛА, острых заболеваний органов брюшной полости, расслаивающей аневризмы аорты. При затянувшемся приступе стенокардии следует учитывать, что причинами увеличения длительности привычной ангинозной боли могут быть не только развивающийся острый коронарный синдром или инфаркт миокарда, но и сохраняющееся повышение артериального давления либо увеличение ЧСС. Ухудшение реакции на прием нитроглицерина может быть связано со снижением активности препарата. Напротив, должны настораживать случаи изменения локализации или иррадиации боли, которые обычно свидетельствуют о дестабилизации течения стенокардии или о развивающемся инфаркте миокарда. Для дифференциальной диагностики субэндокардиального (без патологического зубца О) инфаркта миокарда и стенокардии рекомендуют регистрировать ЭКГ до и после сублингвального приема нитроглицерина. При необратимых изменениях в сердечной мышце динамики реполяризации на ЭКГ не отмечается, однако надежность данного теста невысока. При ТЭЛА ведущим симптомом всегда остается одышка (без яркой аускультативной симптоматики, не зависящая от положения тела). Характерны наличие факторов риска тромбоэмболических осложнений, артериальной гипотензии, тахикардии. При внезапном появлении одышки и артериальной гипотензии в первую очередь следует подумать о ТЭЛА! При острых заболеваниях органов брюшной полости (прежде всего остром панкреатите) боль часто уменьшается после приема нитроглицерина, а на ЭКГ могут проявиться изменения, аналогичные таковым при острой коронарной недостаточности или нижнем инфаркте миокарда. При дифференциальной диагностике следует учитывать наличие отягощенного по ИБС анамнеза, цианоза, одышки, глухого I тона, болезненности при пальпации живота, симптомов раздражения брюшины. При расслаивающей аневризме аорты клинические проявления зависят от уровня поражения. Особенно трудно дифференцировать инфаркт миокарда и поражение грудного отдела аорты. В последнем случае боль в грудной клетке, как правило, сильная, нестерпимая. Она начинается внезапно, сразу с максимальной интенсивностью, иррадиирует вдоль позвоночника, имеет волнообразное течение. Объективно отмечаются выраженная артериальная гипертензия (на поздней стадии – гипотензия), расширение сосудистого пучка, систолический шум над аортой, иногда – признаки гемоперикарда, асимметрия пульса. При дифференциальной диагностике следует учитывать резкое несоответствие интенсивности и длительности боли скудным изменениям ЭКГ. Во всех сложных для диагностики случаях серьезным подспорьем является экспресс-тест с тропонином-Т. Формулировка развернутого клинического диагноза ИМ должна отражать: 1) характер течения (рецидивирующий, с затяжным течением, повторный); 2) глубину некроза; 3) локализацию ИМ; 4) дату возникновения ИМ; 5) осложнения; 6) фоновые заболевания – атеросклероз коронарных артерий и других сосудов (отсутствие атеросклероза коронарных артерий отмечается при соответствующих данных коронарографии); 7) стадию гипертонической болезни (при ее наличии); 8) стадию недостаточности кровообращения (при ее наличии). ЛечениеЛечение при неосложненном трансмуральном инфаркте миокарда должна включать мероприятия по: 1) обезболиванию; 2) восстановлению коронарного кровотока; 3) ограничению размеров некроза; 4) предупреждению возникновения ранних осложнений. Большинство применяемых при инфаркте миокарда лекарственных препаратов одновременно действует по нескольким направлениям. Обезболивание следует проводить с учетом вида и тяжести болевого синдрома, особенностей течения инфаркта миокарда, возраста и состояния больного. Чаще всего врач скорой помощи сталкивается с ангинозным статусом, однако у больного с инфарктом миокарда могут быть и другие боли. Ангинозные боли необходимо устранить максимально быстро и полно! Важные компоненты обезболивания – снижение потребности миокарда в кислороде (ограничение физической нагрузки, щадящая транспортировка, элементы психотерапии, применение транквилизаторов или нейролептиков, коррекция артериального давления и ЧСС). Всем больным следует проводить оксигенотерапию. Показано раннее применение антиангинальных средств, что одновременно способствует и ограничению размеров некроза. Пациентам без артериальной гипотензии и брадикардии назначают 0,5 мг нитроглицерина под язык, далее при тяжелом ангинозном болевом синдроме 10 мг нитроглицерина в 100 мл 0,9 %-го раствора натрия хлорида вводят внутривенно капельно, а при умеренной боли дают под язык повторно. Всем больным, не имеющим противопоказаний, необходимо раннее назначение блокаторов В-адренорецепторов (пропранолол, метопролол, бетаксолол и др.). Лечение начинают с внутривенного введения препаратов (это наиболее эффективно), однако на догоспитальном этапе блокаторы В-адренорецепторов наиболее безопасно назначать внутрь. Пропранолол в первые 4 ч заболевания по 1 мг вводят внутривенно повторно (суммарная доза не должна превышать 6 мг) или в дозе 20–40 мг внутрь. Метопролол в первые часы инфаркта миокарда рекомендуют вводить внутривенно по 5 мг в течение 2 мин, повторяя инъекции с интервалом в 5 мин до достижения суммарной дозы 15 мг. Далее препарат назначают внутрь по 50 мг через 6 ч (200 мг/сут). Антагонисты кальция при оказании неотложной помощи больным с ангинозным болевым статусом используют в дополнение к нитроглицерину при противопоказаниях к лечению В-адреноблокаторами или подозрении на спазм коронарных артерий. Назначают внутрь 40–80 мг верапамила или 30–60 мг дилтиазема. Одновременно необходимо использовать болеутоляющие средства. Наиболее эффективны внутривенное дробное введение морфина или нейролептаналыезия (обычно используют фентанил, реже промедол, в сочетании с дроперидолом). Морфин обладает мощной анальгетической активностью, вызывает чувство эйфории, устраняет тревогу и страх, повышает парасимпатический тонус (брадикардия), вызывает дилатацию периферических артерий и вен («бескровную флеботомию»), но может угнетать дыхание и усиливать активность рвотного центра. Бесспорными достоинствами морфина следует признать не только выраженное болеутоляющее действие, сопровождающееся седативным эффектом и эйфорией, но и то, что препарат уменьшает гемодинамическую нагрузку на сердце за счет снижения тонуса периферических вен и артерий (пред– и постнагрузки). Другое достоинство морфина – стимуляция парасимпатического тонуса, имеющая кардиопротекторное значение. Этот эффект морфина (конечно, в разумных пределах) скорее надо использовать, чем подавлять с помощью атропина. Морфин показан в случаях тяжелого ангинозного статуса у пациентов среднего возраста, при преимущественной локализации некроза на передней стенке, особенно в сочетании с артериальной гипертензией, тахикардией или застойной сердечной недостаточностью. Вводить морфин следует только внутривенно, в 2–3 этапа, в общей дозе до 10 мг (1 мл 1%-го раствора). Морфин нельзя применять у пожилых, ослабленных больных с признаками угнетения дыхания. Препарат противопоказан при артериальной гипотензии, гиповолемии, тяжелом поражении правого желудочка, локализации некроза на нижней стенке с синдромом «брадикардия-гипотензия». Фентанил обладает быстро развивающейся, мощной, но непродолжительной обезболивающей активностью, повышает парасимпатический тонус, несколько снижает сократительную способность сердца, может угнетать дыхание, спровоцировать бронхоспазм и брадикардию. Препарат вводят внутривенно медленно в дозе 0,1 мг (2 мл 0,005 %-го раствора) в два этапа. Больным пожилого возраста или с массой тела меньше 50 кг назначают 0,05 мг (1 мл 0,005 %-го раствора) фентанила. Действие препарата развивается через 1 мин, достигает максимума через 3–7 мин, но продолжается не более 25–30 мин. Недооценка кратковременности действия фентанила на догоспитальном этапе является одной из основных причин возобновления боли во время транспортировки. Промедол дает относительно слабый обезболивающий эффект, умеренно угнетает дыхание. Препарат вводят в дозе 20 мг (1 мл 2%-го раствора) внутривенно медленно в два этапа. Действие начинается через 3–5 мин и продолжается примерно 2 ч. Для проведения нейролептанальгезии наркотический анальгетик (фентанил или промедол) применяют совместно с нейролептиком (чаще дроперидолом). Дроперидол – препарат, вызывающий состояние нейролепсии с эмоциональной нечувствительностью к различным раздражителям при сохранении сознания. Механизм действия препарата обусловлен блокадой альфа-адренорецепторов, прерывающей поток афферентной импульсации в ЦНС и вызывающей периферическую вазодилатацию и снижение артериального давления. Кроме того, дроперидол замедляет АВ-проведение и оказывает противорвотное действие. Ввиду влияния на артериальное давление доза дроперидола выбирается в зависимости от его исходного значения: при систолическом давлении 100–110 мм рт. ст. – 2,5 мг препарата, 120–160 мм рт. ст. – 5 мг, свыше160—180 мм рт. ст. – до 10 мг. Основные проблемы, возникающие при обезболивании: 1) недостаточный анальгетический эффект; 2) отсутствие наркотических средств (отсутствие разрешения на применение наркотических анальгетиков); 3) побочные эффекты наркотических анальгетиков (угнетение дыхания, тошнота, нарушения гемодинамики); 4) особые ситуации, не поддающиеся традиционным методам лечения (боль при медленнотекущсм разрыве миокарда). Недостаточное обезболивание, как правило, является следствием неадекватного выбора препарата, его дозы или способа применения. Например, назначение наркотических анальгетиков с умеренной болеутоляющей активностью (промедол) молодым пациентам с очень сильной болью, введение анальгетиков подкожно или внутримышечно и др. Болеутоляющую активность наркотических средств можно усилить с помощью нейролептиков (дроперидол), транквилизаторов (диа-зепам), ненаркотических анальгетиков (анальгин). Анальгин при выраженном ангинозном статусе у больных молодого и среднего возраста не эффективен. Назначение анальгина показано для потенцирования действия наркотических анальгетиков либо при исходно слабой боли у пациентов старческого возраста. В этих случаях внутривенное введение анальгина в дозе 2,5 г вместе с 5—10 мг диазепама либо 5 мг дроперидола может оказаться эффективным. У больных с сохраняющейся артериальной гипертензией для потенцирования болеутоляющего действия наркотических анальгетиков эффективно внутривенное введение клонидина. Клонидин (клофелин) – гипотензивный препарат, стимулятор альфа-адренорецепторов ЦНС. Помимо гипотензивного действия клофелин обладает обезболивающей и седативной активностью, устраняет эмоционально-аффективные, моторные и гемодинамические реакции на боль. По нашим данным, на фоне действия наркотических анальгетиков медленное внутривенное введение 0,1 мг препарата (1 мл 0,01 %-го раствора) через 5—10 мин в большинстве случаев приводит к полному подавлению боли. При невозможности применения наркотических анальгетиков (отсутствии разрешения на их использование) следует вводить буторфанол, трамадол или анальгин. Буторфанол (стадол, морадол) – агонист-антагонист опиатных рецепторов. При инфаркте миокарда применение буторфанола оправдано только при отсутствии традиционных наркотических средств. Буторфанол вводят в дозе 2 мг внутривенно медленно вместе с 5 мг дроперидола. В этих же случаях можно использовать внутривенное введение 100 мг трамадола (трамала) или 2,5 г анальгина с 5 мг дроперидола или 5—10 мг диазепама. Буторфанол и трамадол непригодны для потенцирования болеутоляющего действия традиционных наркотических анальгетиков. Побочные эффекты наркотических анальгетиков чаще проявляются угнетением дыхания, реже – кровообращения. Угнетение дыхания обычно развивается вследствие неправильного выбора препарата или сочетания препаратов, дозировок и, главное, скорости внутривенного введения (не учтены возраст, сопутствующие заболевания, осложнения, предшествующая терапия и т. п.). При угнетении дыхания вследствие применения наркотических анальгетиков больные, как правило, остаются доступными для словесного контакта, поэтому прежде всего следует попытаться использовать команды «вдох – выдох». В тяжелых случаях для восстановления дыхания назначают специфический антагонист наркотических анальгетиков налоксон. Использовать с этой целью дыхательные аналептики (кордиамин, коразол и др.) недопустимо! Отрицательные гемодинамические эффекты при медленном однократном введении большинства наркотических анальгетиков в терапевтических дозах, как правило, не проявляются. Неблагоприятные гемодинамические реакции обычно развиваются в случаях, когда не было учтено исходное состояние больного или влияние других лекарственных средств (применение морфина у больных с артериальной гипотензией или гиповолемией и т. п.). Следует учитывать, что, помимо ангинозной боли, при инфаркте миокарда встречаются и другие ее разновидности. Остаточные боли – это ощущения, сохраняющиеся в грудной клетке после лечения ангинозного статуса. Остаточные боли всегда тупые, неинтенсивные, «глухие», с ограниченной локализацией, без иррадиации, без гемодинамических и моторной реакций. Пациенты часто характеризуют их словом «наболело». Перикардиальные боли, в отличие от ангинозных и остаточных, всегда острые, колющие. Они возникают или усиливаются на вдохе или при повороте на бок. Перикардиальная боль локализуется в области верхушки сердца или левой половине грудной клетки. При эпистенокардическом перикардите боль может сопровождаться шумом трения перикарда; при синдроме Дресслера – как шумом трения перикарда, так и шумом трения плевры. Указанные шумы удается выслушать далеко не всегда, и их отсутствие не свидетельствует об иной разновидности боли. При остаточных и перикардиальных болях интенсивного обезболивания не требуется. Важно предупредить больного о необходимости сообщать о любых изменениях этих ощущений. На высоте перикардиальной боли, а также при умеренном усилении остаточной назначают ненаркотические анальгетики: анальгин 2,5 г (5 мл 50 %-го раствора) внутримышечно либо внутривенно в сочетании с диазепамом (седуксен, реланиум) в дозе 5—10 мг. Боль при медленнотекущем разрыве миокарда чрезвычайно интенсивная, разрывающая, раздирающая, «кинжальная», жгучая, палящая, иногда с несколькими периодами кратковременного ослабления. Болевые ощущения захватывают всю грудную клетку, иррадиируют очень широко – в оба плеча и предплечья, верхнюю половину брюшной полости, шею, нижнюю челюсть, вдоль позвоночника. Возникает боль при медленнотекущем разрыве в период развития этого осложнения – на 2—5-е сутки инфаркта миокарда, иногда непосредственно продолжая ангинозный статус. Сохраняется эта разновидность боли до полного завершения разрыва. К особенностям болевого синдрома при медленнотекущем разрыве следует отнести возможность кратковременных эпизодов потери сознания в момент возникновения боли, всегда сопутствующий боли шок, резистентность к проводимой интенсивной терапии. На догоспитальном этапе полноценного обезболивания добиться практически невозможно, в стационаре эффекта можно достичь с помощью перидуральной анестезии на уровне Т11—12. При невозможности проведения перидуральной анестезии, уверенности в диагнозе и соответствующей квалификации врача приходится вводить субнаркотические дозы препарата для общей анестезии – кетамина. По методике, разработанной на кафедре неотложной медицины СПбМАПО (Кузнецова О. Ю., Ландер Н. М, 1989), 50 мг кетамина и 10 мг диазепама в 100 мл 0,9 %-го раствора натрия хлорида вводят внутривенно капельно, начиная со скорости 50–60 капель/мин и снижая ее по мере наступления эффекта. Средняя скорость инфузии составляет 0,04 мг/(кг х мин), а общая доза кетамина, необходимая для обезболивания – 0,75 мг/кг. Восстановление коронарного кровотока. Причиной трансмурального (с патологическим зубцом Q) инфаркта миокарда является тромботическая окклюзия коронарной артерии, поэтому раннее устранение тромба может иметь определяющее значение для течения и исхода заболевания. Формирование патологического зубца Q требует времени, поэтому при решении вопроса о проведении тромболитической терапии ориентируются на клинические данные и наличие подъема сегмента ST над изоэлектрической линией. Показания к тромболитической терапии: ангинозная боль, сохраняющаяся без поддерживающих факторов более 30 мин и не проходящая от повторного приема нитроглицерина, сопровождающаяся либо подъемом сегмента ST на 1 мм и более по крайней мере в двух смежных прекардиальных отведениях или в двух из трех «нижних» отведениях ЭКГ (II, III, aVP), либо появлением блокады ножки пучка Гиса. Тромболитическая терапия показана в первые 6 ч (при сохраняющейся или рецидивирующей боли – в первые 12–24 ч заболевания). При инфаркте миокарда, протекающем с депрессией сегмента ST (субэндокардиальном), тромболитическая терапия не показана. Исключение составляет трансмуральный заднебазальный инфаркт миокарда с депрессией сегмента SТ и высоким зубцом R в отведениях V1—V2. Противопоказания к тромболитической терапии приводятся согласно рекомендациям Европейского кардиологического общества (1996). Абсолютные противопоказания: 1) инсульт; 2) тяжелая травма; 3) хирургическое вмешательство или травма головы в предшествующие 3 недели; 4) желудочно-кишечное кровотечение в предшествующие 30 дней; 5) склонность к кровотечениям; 6) расслаивающая аневризма аорты. Относительные противопоказания: 1) ПНМК в предшествующие 6 месяцев; 2) лечение непрямыми антикоагулянтами; 3) беременность; 4) пункция сосудов, не поддающихся прижатию; 5) травматичная СЛР; 6) неконтролируемая артериальная гипертензия (систолическое давление выше 180 мм рт. ст.); 7) недавнее лечение сетчатки с помощью лазера. При наличии относительных противопоказаний в каждой конкретной клинической ситуации необходимо оценить не только риск, но и предполагаемую пользу тромболитической терапии, руководствуясь тем, что инфаркт миокарда – это заболевание, непосредственно угрожающее жизни. Для тромболитической терапии используют стрептокиназу (СК; стрептаза, кабикиназа, авелизин). СК активирует плазминоген, в результате чего он превращается в плазмин, который переводит фибрин в растворимое состояние. Препарат вводят внутривенно капельно в дозе 1 500 000 ЕД в 100 мл 0,9 %-го раствора натрия хлорида в течение 20–30 мин. При повышенном риске аллергических реакций перед введением СК внутривенно струйно вводят 30 мг преднизолона, хотя это не является обязательным. Лечение СК результативно в первые 6—12 ч инфаркта миокарда. Эффективность терапии СК повышается при назначении ацетилсалициловой кислоты, но не гепарина. Признаки эффективности тромболитической терапии: 1) прекращение ангинозной боли; 2) нормализация или значительное смещение сегмента ST к изоэлектрической линии (при этом зубец Т обычно остается отрицательным, а патологический зубец Q либо уменьшается, либо не изменяется); 3) появление реперфузионных аритмий (ускоренный идиовентрикулярный ритм, желудочковые экстрасистолы, желудочковая тахикардия, фибрилляция желудочков, АВ-блокады и др.). Следует отметить, что сократительная способность миокарда при реперфузип восстанавливается не сразу (феномен «оглушенного миокарда»). Осложнения тромболитической терапии 1. Реперфузионные аритмии – самое частое осложнение тромболитической терапии и одновременно косвенное свидетельство восстановления коронарного кровотока. Их лечение осуществляется по общим принципам. 2. Феномен «оглушенного миокарда» проявляется признаками острой застойной сердечной недостаточности. Реокклюзия коронарной артерии наблюдается в 15–20 % случаев, может протекать бессимптомно или проявляться возобновлением ангинозной боли и ухудшением гемодинамики. Для лечения этого осложнения используют внутривенное капельное введение нитроглицерина, назначают гепарин и ацетилсалициловую кислоту. 3. Кровотечения. При кровотечении из мест пункции вен достаточно наложить давящую повязку, не прекращая введения тромболитического препарата. Следует избегать пункции крупных (особенно неспадающихся) сосудов. При тяжелом кровотечении в качестве ингибитора фибринолиза внутривенно вводят 100 мл 5%-го раствора АКК. 4. Артериальная гипотензия обычно корригируется снижением скорости введения СК. Если этого недостаточно, то введение тромболитического препарата прекращают, приподнимают нижние конечности пациента на 20°, проводят инфузионную терапию. В тяжелых случаях назначают глюкокортикоидные гормоны (преднизолон по 30–60 мг). При упорной артериальной гипотензии необходимо убедиться, что она не связана с внутренним кровотечением! 5. Аллергические реакции требуют немедленного прекращения введения тромболитика и, в зависимости от клинических проявлений, назначения антигистаминных препаратов, кортикостероидных гормонов, бронхолитиков, а при развитии анафилактического шока – адреналина. СК обладает антигенными свойствами, после лечения высокий титр антител к ней сохраняется долго. 6. Геморрагический инсульт обычно встречается у больных старческого возраста с неконтролируемой артериальной гипертензией. Частота развития геморрагического инсульта увеличивается при назначении СК с гепарином. Если тромболитическая терапия не проводилась, то необходимо лечение гепарином в сочетании с ацетилсалициловой кислотой. Особенно показан гепарин при инфаркте миокарда без патологического зубца Q (с депрессией сегмента ST), а также при повышенном риске тромботических осложнений (у пожилых, при сердечной недостаточности, мерцании предсердий, тромбоэмболиях в прошлом и др.). Противопоказано назначение гепарина при кровотечениях, геморрагическом диатезе, остром перикардите. Вначале внутривенно струйно вводят 5000 ЕД гепарина, затем переходят на внутривенное капельное вливание препарата с начальной скоростью 1000 ЕД/ч. В стационаре скорость вливания препарата подбирают так, чтобы увеличить активированное частичное тромбопластиновое время (АЧТВ) в 1,5–2,5 раза по сравнению с исходным. АЧТВ определяют каждые 6 ч, пока не будет достигнута его стабилизация на необходимом уровне в 2–3 последовательных анализах, а затем 1 раз в сутки. Удобнее использовать низкомолекулярные гепарины, например эноксапарин (клекcан), который назначают подкожно по 1 мг/кг 2 раза в сутки. Ацетилсалициловая кислота (аспирин), как прямой антиагрегант, показана с первых суток инфаркта миокарда независимо от того, проводилась тромболитическая терапия или нет. Начинать лечение следует как можно раньше, первую дозу ацетилсалициловой кислоты (250–325 мг) рекомендуют разжевать. В дальнейшем доза препарата может быть существенно снижена (125 мг/сут). Ограничению размеров некроза способствуют своевременное и полноценное обезболивание, применение СК или гепарина и ацетилсалициловой кислоты, раннее и адекватное назначение блокаторов (B-адренорецепторов и нитроглицерина, коррекция артериального давления и сердечного ритма. Профилактика ранних осложнений, прежде всего фибрилляции желудочков, особенно важна в первые часы инфаркта миокарда. Чем меньше времени прошло от начала ангинозного приступа, тем больше опасность внезапного резкого (вплоть до остановки кровообращения) ухудшения течения болезни. Поэтому во всех случаях (даже если состояние больного формально удовлетворительное) необходимо обеспечить постоянное наблюдение и мониторировать сердечный ритм. В первые часы заболевания или при нестабильном состоянии больного показана профилактическая катетеризация периферической вены. Аппараты, инструменты, растворы и лекарственные средства для усложненной СЛР следует содержать в постоянной готовности к немедленному применению. Основу предупреждения осложнений, в том числе и фибрилляции желудочков, у больных с инфарктом миокарда составляет комплекс лечебных мероприятий: своевременное полноценное обезболивание, назначение антиангинальных средств, коррекция артериального давления и сердечного ритма, щадящая транспортировка, оксигенотерапия. Особое значение имеет раннее и адекватное применение блокаторов B-адренорецепторов. Внутривенное введение пропранолола, метопролола или атенолола в первые часы инфаркта миокарда снижает частоту фибрилляции желудочков и летальность. Профилактическое введение лидокаина при остром инфаркте миокарда снижает частоту развития фибрилляции желудочков, но значительно увеличивает количество случаев асистолии. Поэтому в рекомендациях Европейского кардиологического общества и Европейского совета по реанимации (1998) подчеркивается, что профилактическое назначение лидокаина при остром инфаркте миокарда не показано. Магния сульфат при остром инфаркте миокарда показан в первые часы заболевания только при желудочковых или наджелудочковых аритмиях, рефрактерных к лечению лидокаином или пропранололом, либо в случае противопоказаний к их назначению. Для лечения аритмий 2 г магния сульфата вводят внутривенно в течение 5—10 мин. На 2—4-й день заболевания добавляют ингибиторы АПФ (каптоприл, эналаприл, рамиприл, периндоприл). Установлено, что они оказываются особенно эффективными, если у больных с острым ИМ имелось снижение фракции выброса или были признаки сердечной недостаточности в ранней фазе заболевания. Назначение ингибиторов АПФ показано всем больным, перенесшим ранее ИМ. В лечении больных острым ИМ без зубца Q применяется, как правило, терапия гепарином, нитратами и B-адреноблокаторами. Осложнения острого инфаркта миокарда1. Нарушения сердечного ритма и проводимости, особенно в первые часы инфаркта миокарда, встречаются у большинства больных. Желудочковые экстрасистолы наблюдаются практически у всех больных в первые сутки инфаркта миокарда. Для определения их прогностического значения используют модифицированные градации B. Lown и M. Wolf: I – до 30 экстрасистол за любой час мониторирования; II – свыше 30 экстрасистол за любой час мониторирования; III – полиморфные экстрасистолы; IVa – мономорфные парные экстрасистолы; IVb – полиморфные парные экстрасистолы; V – 3 и более экстрасистолы подряд с частотой эктопического ритма больше 100 в 1 мин. Хотя показано, что при желудочковых экстрасистолах III–IV градаций частота фибрилляции желудочков возрастает, почти в половине случаев ее возникновению не предшествуют «опасные» экстрасистолы. Не случайно в последнее время эти желудочковые экстрасистолы стали называть «косметическими». В 1—3-и сутки инфаркта миокарда желудочковые экстрасистолы носят транзиторный характер, в большинстве случаев не требуют лечения и проходят самостоятельно. При наличии желудочковых экстрасистол высоких градаций, как, впрочем, и при их отсутствии, важно обеспечить непрерывное наблюдение за сердечным ритмом и готовность к немедленному проведению дефибрилляции. Желудочковые тахикардии ранней аритмической фазы инфаркта миокарда развиваются в 1—3-и сутки заболевания обычно по механизму re-entry, протекают с частотой 150–200 в 1 мин, неустойчивы, могут трансформироваться в фибрилляцию желудочков, высокочувствительны к лидокаину и электроимпульсной терапии (ЭИТ). Желудочковые тахикардии поздней аритмической фазы развиваются на 3—4-й неделе инфаркта миокарда вследствие повышения автоматизма эктопических очагов или триггерной активности в зоне формирующегося рубца или аневризмы, протекают с частотой 180–220 в 1 мин, устойчивы к лечению, вызывают тяжелые расстройства гемодинамики, имеют крайне неблагоприятное прогностическое значение. Пароксизм желудочковой тахикардии иногда (в самом начале) удается оборвать с помощью кашля или удара по грудине. Для лечения желудочковой тахикардии препаратом выбора является лидокаин. Лидокаин в дозе 1–1,5 мг/кг вводят внутривенно медленно, а затем по 0,5–0,75 мг/кг каждые 5 мин до подавления тахикардии или достижения суммарной дозы 3 мг/кг. При упорном течении и рецидивах тахикардии прибегают к внутривенным инъекциям амиодарона (кордарона), который вводят внутривенно в дозе 300 мг (5 мг/кг) в течение 10 мин, а далее капельно до 1200 мг/сут. Если желудочковая тахикардия развивается на фоне лечения сердечными гликозидами (даже в малых дозах), то показано медленное внутривенное введение 2 г магния сульфата. Тяжелые нарушения гемодинамики (отек легких, шок), вызванные аритмией, являются абсолютным жизненным показанием к проведению ЭИТ. От желудочковой тахикардии следует отличать ускоренный идиовентрикулярный ритм (60—100 в 1 мин). Такой ритм является замещающим, и его нельзя подавлять с помощью антиаритмических средств. Фибрилляция желудочков при инфаркте миокарда может быть первичной и вторичной. Первичная фибрилляция желудочков возникает внезапно на фоне относительно удовлетворительного состояния больного, в большинстве случаев в самом начале заболевания. Приблизительно 80 % всех случаев фибрилляции желудочков происходит в первые сутки, а примерно 50 % – в первые 2 ч инфаркта миокарда. Вторичная фибрилляция желудочков развивается как атональный ритм на фоне других тяжелых осложнений заболевания, прежде всего – нарастающей сердечной недостаточности. Показаны проведение СЛР и немедленная дефибрилляция. Наджелудочковые тахиаритмии обычно связаны со стрессорной активацией кровообращения, сердечной недостаточностью, нарушениями электролитного баланса. Значимость и характер лечения этих аритмий зависят от причины их возникновения, ЧСЖ, продолжительности пароксизма и состояния миокарда. Аритмии, обусловленные стрессорной активацией кровообращения (синусовая или предсердная тахикардия, предсердные экстрасистолы), обычно протекают благоприятно и проходят после устранения причин стресса при полноценном обезболивании либо при применении B-адреноблокаторов. У больных с пароксизмами мерцательной аритмии в 1—2-е сутки заболевания благоприятный эффект может быть получен при внутривенном капельном введении 300 мг амиодарона, оказывающего не только антиаритмическое, но и антиадренергическое и антиангинальное действие. Аритмии, обусловленные сердечной недостаточностью (синусовая или предсердная тахикардии и, особенно, мерцание или трепетание предсердий), протекают тяжело, быстро и значительно ухудшают гемодинамику. Лечить такие нарушения ритма антиаритмическими препаратами опасно. При высокой ЧСС и значительном ухудшении кровообращения методом выбора остается ЭИТ. Если пароксизмы мерцания предсердий протекают с ЧСЖ до 150 в 1 мин и не вызывают тяжелых нарушений системного или регионарного кровообращения, то назначают внутривенное капельное введение 0,25 мг дигоксина или строфантина с препаратами калия и магния. При умеренной застойной сердечной недостаточности эффективно внутривенное капельное введение 300–450 мг амиодарона. Для экстренного снижения ЧСЖ назначают 20–40 мг пропранолола (анаприлин, обзидан) внутрь. Наджелудочковые тахикардии нередко обусловлены другими факторами, которые необходимо учитывать перед назначением лечения. Так, синусовая тахикардия может быть следствием гипоксемии, нарушения электролитного баланса, гиповолемии, гипертермии, рецидивирующего течения инфаркта миокарда, перикардита, тромбоэндокардита, тромбоэмболии, кровотечения, применения лекарственных средств. Очаговая предсердная тахикардия с АВ-блокадой II степени часто возникает вследствие передозировки сердечных гликозидов, развивающейся при инфаркте миокарда особенно быстро, даже при назначении препаратов в малых дозах. В этих случаях может быть эффективным медленное внутривенное введение 2 г магния сульфата или капельное вливание препаратов калия и магния (глюкоза 5 % – 500 мл, калия хлорид 4 % – 40 мл, магния сульфат 25 % – 10 мл, инсулин – 6 ЕД). Ускоренный ритм из АВ-соединения (60—100 в 1 мин) является замещающим, и его нельзя подавлять с помощью антиаритмических средств. АВ-блокады при инфаркте нижней стенки возникают проксимально на уровне АВ-соединения, развиваются постепенно от I ко II и III степени, после чего проведение через АВ-узел медленно восстанавливается. ЧСЖ даже при полной предсердно-желудочковой блокаде этой локализации остается относительно удовлетворительной (40–50 в 1 мин) и стабильной. Такие блокады обычно не вызывают тяжелых нарушений гемодинамики, протекают относительно благоприятно и мало влияют на исход заболевания. ЭКС показана при тяжелых нарушениях гемодинамики или нарастающей эктопической желудочковой активности. Предсердно-желудочковая блокада при инфаркте миокарда передней локализации протекает тяжело и резко ухудшает прогноз заболевания. В этих случаях она возникает внезапно или на фоне блокады ножки пучка Гиса, развивается дистально, протекает с низкой (менее 35 в 1 мин) и, главное, неустойчивой ЧСЖ. Поэтому при дистальной предсердно-желудочковой блокаде ЭКС необходима даже при относительно удовлетворительной частоте замещающего ритма. Для оказания экстренной помощи при выраженной брадикардии с артериальной гипотензией больному следует придать положение с приподнятыми нижними конечностями. Важно обеспечить постоянный контроль за сердечным ритмом и проводимостью, готовность к проведению ЭКС. Внутривенно струйно вводят 1 мг (1 мл 0,1 %-го раствора) атропина, инъекции можно повторять до получения эффекта или достижения суммарной дозы 0,04 мг/кг. Показано экстренное проведение эндокардиальной ЭКС. В случаях, когда атропин неэффективен, а немедленное осуществление ЭКС невозможно, остается попытаться увеличить ЧСЖ с помощью других лекарственных средств. Для этого рекомендуют назначать адреналин, допамин или изопротеренол. Использование указанных препаратов (а по нашим данным – и атропина) ограничено их низкой эффективностью и опасно. Альтернативным методом экстренной помощи может быть применение аминофиллина. Аминофиллин (эуфиллин) – бронхолитик, блокатор пуриновых рецепторов кардиомиоцитов, чувствительных к аденозину, ингибирует фосфодиэстеразу, способствует накоплению цАМФ, улучшению адренергической иннервации, повышению СА– и АВ-проводимости. По нашим данным, при брадикардиях, угрожающих жизни, развившихся на фоне применения лекарственных средств (антиаритмических препаратов, сердечных гликозидов), или у больных с острым инфарктом миокарда введение эуфиллина не только более эффективно, но и более безопасно, чем традиционное использование атропина. Нарушения внутрижелудочковой проводимости при остром инфаркте миокарда могут проявляться в виде блокады правой или левой ножки пучка Гиса либо ветвей левой ножки (передневерхней, задненижней, срединной) и их сочетаний, а также местными интра– или периинфарктными блокадами. Нарастающее ухудшение внутрижелудочковой проводимости обычно свидетельствует об обширном поражении миокарда и может предшествовать возникновению полной поперечной блокады сердца! При внутрижелудочковых блокадах важно избегать назначения лекарственных средств, ухудшающих внутрижелудочковое проведение, прежде всего антиаритмических; обеспечить контроль сердечного ритма и проводимости и готовность к проведению ЭКС. Асистолия при инфаркте миокарда обычно развивается вторично как атональный ритм на фоне других тяжелых осложнений заболевания, что предопределяет низкую эффективность реанимационных мероприятий при ее возникновении. Острая сердечная недостаточность Уменьшение массы функционирующего миокарда обусловливает высокую частоту нарушений гемодинамики при инфаркте миокарда. Умеренный застой в малом круге кровообращения может наблюдаться вследствие ухудшения диастолической функции сердца. При нарушении систолической функции и снижении сердечного выброса отмечают, кроме влажных хрипов в легких, увеличение размеров сердца, III тон, пресистолический или протодиастолический ритм галопа. Ориентировочно степень сердечной недостаточности при инфаркте миокарда оценивают по классификации T. Killip: I – признаков сердечной недостаточности нет; II – умеренная сердечная недостаточность (влажные хрипы не более чем над 50 % поверхности легких); III – отек легких; IV – шок (систолическое давление менее 90 мм рт. ст., признаки гипоперфузии периферических участков тела, включая снижение температуры и повышенную влажность кожи, уменьшение диуреза и спутанное сознание). Для оказания экстренной помощи при умеренной острой застойной сердечной недостаточности (Killip II) основное значение имеет применение быстродействующих диуретиков (лазикс), нитроглицерина, ингибиторов АПФ (каптоприл). Следует учитывать, что при инфаркте миокарда, помимо истинного, встречаются и другие виды шока: 1) рефлекторный; 2) аритмический (тахи-, брадиаритмический); 3) при медленнотекущем разрыве; 4) при повреждении сосочковых мышц; 5) при разрыве межжелудочковой перегородки; 6) при инфаркте правого желудочка; 7) лекарственный. Очевидно, что при рефлекторном шоке основное значение в оказании неотложной помощи имеет быстрое и полноценное обезболивание. Аритмический шок является абсолютным жизненным показанием для проведения ЭИТ или ЭКС. При шоке вследствие медленнотекущего разрыва помочь может только экстренное хирургическое вмешательство. Об экстренной помощи при внутренних разрывах см. ниже. Сердечная недостаточность при инфаркте правого желудочка проявляется артериальной гипотензией, одышкой без выраженного застоя в легких, значительным повышением ЦВД с набуханием шейных вен, синдромом Куссмауля, правожелудочковым ритмом галопа, аускультативными признаками трикуспидальной недостаточности. Неотложная помощь при поражении правого желудочка направлена на увеличение пред– и снижение постнагрузки, а также на повышение сократимости миокарда. Для повышения преднагрузки проводят инфузионную терапию по тем же критериям, что и при истинном кардиогенном шоке. Из препаратов с положительным инотропным действием при относительной артериальной гипотензии назначают добутамин, при выраженной – допамин. Неотложная помощь при острой лекарственной гипотензии зависит от вызвавшего ее препарата. При передозировке B-адреноблокаторов назначают стимуляторы B-адренорецепторов (добутамин, допамин), при избыточном действии антагонистов кальция – внутривенное введение кальция хлорида. При передозировке нитропрепаратов больного необходимо уложить с поднятыми нижними конечностями и проводить инфузионную терапию. При тяжелой артериальной гипотензии следует убедиться в отсутствии таких ее причин, как внутреннее кровотечение из острых эрозий и язв желудочно-кишечного тракта, ТЭЛА, тампонада сердца. Разрывы сердца Различают разрывы ранние и поздние, наружные и внутренние, медленнотекущие и одномоментные, полные и незавершенные. Ранние разрывы чаще возникают в первые дни заболевания на границе между неповрежденным (сокращающимся) и некротизированным участком миокарда. Наружные разрывы с тампонадой сердца встречаются в 10 раз чаще внутренних. Вероятность разрыва и тампонады сердца повышается в пожилом и старческом возрасте, при выраженной артериальной гипертензии, обширном первичном трансмуральном инфаркте миокарда. Клиническая картина складывается из признаков предразрывного периода и симптоматики тампонады сердца. Для предразрывного периода характерны первичное трансмуральное поражение сердечной мышцы (наличие комплекса QS в двух или большем количестве отведений ЭКГ), выраженный (более 5 мм) подъем сегмента ST над изоэлектрической линией, отсутствие положительной динамики ЭКГ, тяжелый болевой синдром с шоком. И боль и шок при этом рефрактерны к традиционной терапии. Временами боль может несколько ослабевать, не прекращаясь полностью, а затем возобновляться с прежней силой. В момент разрыва вследствие тампонады сердца кровообращение прекращается, больные теряют сознание, отмечаются резкий цианоз лица, набухание шейных вен, через 1–2 мин наступает остановка дыхания. Развивается электромеханическая диссоциация, т. е. остановка кровообращения при сохраняющейся электрической активности сердца. Постепенно синусовый ритм замедляется, нарастают нарушения проводимости, водитель ритма смещается в АВ-соединение, а затем в желудочки. Желудочковые комплексы все больше деформируются, расширяются, а их амплитуда снижается. В единичных случаях при разрывах сердца развивается вторичная фибрилляция желудочков. При подозрении на тампонаду сердца необходимо немедленно провести пункцию полости перикарда и срочное хирургическое вмешательство. Пункцию осуществляют в точке между основанием мечевидного отростка и левой реберной дугой длинной тонкой иглой, присоединенной к шприцу с 0,5 %-м раствором новокаина. Новокаин вводят по мере постепенного продвижения иглы, которую направляют влево вверх под углом не более 30° к передней поверхности брюшной стенки. Постоянно потягивают за поршень шприца до появления в нем крови. Убедиться, что игла находится в полости перикарда, а не в желудочке, можно только по явному улучшению состояния больного в ответ на быструю эвакуацию крови. Разрывы перегородки встречаются редко, развиваются на фоне тяжелого болевого синдрома. Сопровождаются резким снижением артериального давления, быстро прогрессирующей правожелудочковой недостаточностью с болями в области правого подреберья вследствие острого увеличения печени, желтухой, набуханием шейных вен. Появляется грубый пансистолический шум, сопровождающийся систолическим дрожанием и проводящийся влево и вправо. На ЭКГ нарастают признаки блокады правой, реже – левой ножки пучка Гиса и перегрузки правого желудочка. Показано экстренное хирургическое вмешательство. При отсутствии шока для оказания экстренной помощи используют внутривенное капельное введение нитроглицерина или натрия нитропруссида, при шоке – допамина. При разрыве или дисфункции папиллярных мышц снижается артериальное давление и бурно нарастают симптомы отека легких. Характерен систолический шум митральной недостаточности, проводящийся влево, усиливающийся при положении на левом боку, иногда сопровождающийся систолическим дрожанием, возможно появление специфического хордального писка. В тяжелых случаях отмечается снижение артериального давления вплоть до шока. Основное значение при оказании неотложной помощи в подобных ситуациях имеет введение нитроглицерина, реже – натрия нитропруссида. При развитии отека легких на фоне резкого снижения артериального давления одновременного вводятся допамин и нитроглицерин. Прочие осложнения. Нельзя забывать о возможности развития таких ранних осложнений инфаркта миокарда, как эрозии и язвы желудочно-кишечного тракта с внутренним кровотечением, парез желудочно-кишечного тракта, острая задержка мочи, нарушения психики, тромбоэмболии, острая аневризма сердца. ГоспитализацияОстрый инфаркт миокарда является абсолютным жизненным показанием к экстренной госпитализации. Важно взять в стационар всю актуальную медицинскую документацию больного, особенно предшествующие электрокардиограммы. Транспортировку проводят на носилках после возможной стабилизации состояния больного, минуя приемные отделения, непосредственно в палату интенсивной терапии специализированных отделений для лечения больных с острым инфарктом миокарда или в отделения реанимации. Необходимо обеспечить наблюдение и готовность к проведению лечебных мероприятий (в том числе реанимационных) в процессе транспортировки. Питание больных в блоке интенсивной терапии не должно быть обременительным для сердечно-сосудистой системы. Суточная энергетическая ценность рациона составляет 1000–1500 ккал. Д. Алперт и Г. Френсис (1994) считают целесообразным не кормить больных в первые 4–6 ч с момента поступления в стационар. Затем при стабильном состоянии больного разрешается прием пищи. В целях уменьшения нагрузки на сердечно-сосудистую систему рекомендуется дробное (5—6-разовое) питание малыми порциями. Разрешается легко усваиваемая, негрубая пища, бедная холестерином и животными жирами, не вызывающая повышенного газообразования. Пища должна содержать достаточное количество калия, растительной клетчатки и не более 4–5 г поваренной соли. В первые дни рекомендуются каши, кисели, суфле, кефир, творог, фруктовые соки, минеральные воды, сухари, несдобное печенье. При отсутствии артериальной гипертензии и недостаточности кровообращения количество принимаемой в сутки жидкости составляет 1–1,5 л. В последующем переходят на диету № 10а, затем на диету № 10. В диету необходимо включать продукты, способствующие опорожнению кишечника (чернослив, курагу, свеклу, винегрет, растительное масло и др.). При развитии запоров применяются растительные слабительные (сенаде, глаксена, экстракт крушины, кафиол и др.), свечи бисокодила и др. Нормализация стула чрезвычайно важна, так как запоры и натуживание ухудшают коронарное кровообращение и способствуют развитию аритмий сердца. |
|
|||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Наверх |
||||
|
|
||||
